Nucleic Acids Research—王传德课题组揭示RPD1蛋白介导线粒体内含子剪接的分子机制
线粒体基因的表达、生物生成和功能实现主要依赖于核基因编码蛋白。这一过程主要通过转录后水平进行调控,包含了广泛的内含子剪接事件。在高等植物中,绝大多数线粒体内含子属于能够自我剪接的II类内含子。然而,由于植物线粒体基因的异质性,其内含子失去了自我剪接的能力,因而必须依靠核编码的蛋白质因子来辅助完成剪接过程。这些剪接因子参与内含子剪接的特异性高度可变,一些剪接因子(即特定剪接因子)参与一个或少数几个内含子剪接;另一些剪接因子(即通用剪接因子)参与了数量众多的内含子剪接事件。然而,这些剪接因子如何参与剪接反应的分子机制尚不清楚。
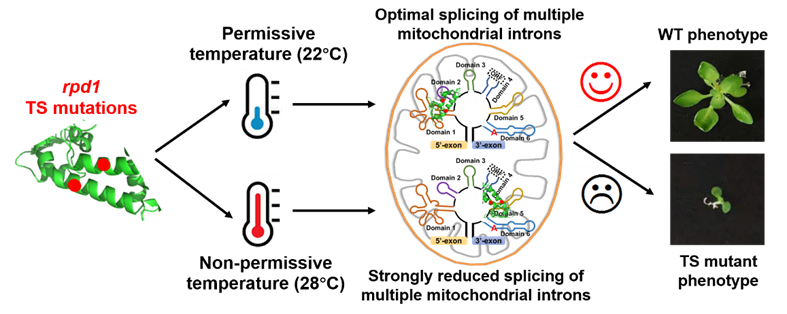
2024年2月14日,上海交通大学农业与生物学院、上海市现代种业协同创新中心(SCCAS)王传德课题组在核酸领域顶级期刊 Nucleic Acids Research 发表了题为 “Temperature-sensitive splicing defects in Arabidopsis mitochondria caused by mutations in the ROOT PRIMORDIUM DEFECTIVE 1 gene”的研究论文,揭示了PORR蛋白家族的RPD1蛋白直接参与多个线粒体内含子的剪接。研究指出,RPD1基因的两个温度敏感性突变对其参与内含子剪接的功能产生了影响,从而证明了高温条件下突变体的不定根发育异常主要是由于RPD1与线粒体内含子的结合能力降低,进而损害了线粒体的功能,而并非由于RPD1直接参与调控拟南芥不定根的形成。此外,RPD1蛋白与目标内含子的多个不同区域相结合,表明RPD1在内含子剪接过程中可能具有多样性机制。

RPD1基因最初因其在调控植物根原基发育中的作用而被发现,其编码蛋白对根系发育具有关键影响。因突变导致根发育异常,故命名为Root Primordium Defective 1。该基因的两种温度敏感突变体在常温(22°C)下能形成不定根,而在高温(28°C)下则不能。进一步研究发现,RPD1蛋白是一个包含15个成员的蛋白家族中的一员,该家族中有三个成员随后被发现参与了线粒体或叶绿体内含子剪接,引发了RPD1可能参与细胞器RNA转录后调控的猜想,尽管其在根发育中的确切作用仍然不明。
为阐明RPD1的分子功能,首先确定了RPD1蛋白在细胞中的定位,发现其主要定位于线粒体,这与之前的核定位假设相悖。对rpd1部分回补突变体植株的深入分析发现,RPD1对于多个线粒体的内含子剪接至关重要,从而证实了其在线粒体剪接中的广泛作用。这一作用与RPD1 的敲除突变体所展现的呼吸链缺陷及胚胎致死现象相一致。此外,在不同温度(22°C和28°C)下对rpd1温度敏感突变体的分析显示,高温(28°C)加剧了线粒体内含子剪接的缺陷,显著降低了线粒体活性,进而抑制了包括根原基细胞在内的细胞分裂。根发育的抑制主要由线粒体功能障碍引起,而非RPD1基因直接参与根形态构建。通过RIP-seq分析确认了RPD1直接与线粒体内含子相结合,且其结合位点跨越不同内含子的多个区域,而这些结合序列间并无显著同源性,这暗示了RPD1参与内含子剪接过程的复杂性与多样性。
上海交通大学王传德教授为论文的第一作者,法国国家农业科学院Hakim Mireau资深研究员为通讯作者。
该研究是王传德团队在细胞器基因表达调控领域的又一重要进展。近期发现核编码蛋白参与细胞器内含子剪切 (PNAS, 2020;Nucleic Acids Research, 2024);较系统地阐明了PPR蛋白参与线粒体RNA 的3’端加工成熟的多样性分子机制 (Nucleic Acids Research, 2017; Plant Physiology, 2022; Nucleic Acids Research, 2023);揭示了油菜核编码蛋白Rfo在翻译水平上抑制不育基因的表达,从而恢复Ogura-CMS的育性 (PNAS, 2021)。